Nature重磅!诺奖得主揭示“另类”潜在抑癌方法:把癌细胞“挤”出去
发布者:医学情报室 来源:生物探索 2021-05-08
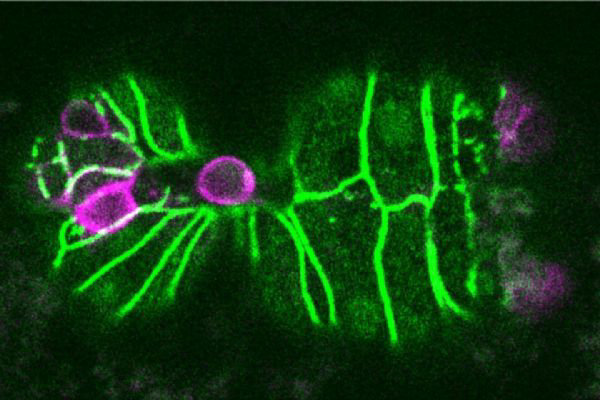 细胞增殖和死亡是维持生命体发生发展必不可少的环节。正常情况下,机体会通过细胞程序性死亡这一主动机制清除“多余”细胞或即将特化的细胞,从而维持增殖细胞和死亡细胞在数量上的平衡。癌症或其他疾病的发生与细胞稳态失衡有关,为此科学家们已经开始探索利用细胞程序性死亡机制治疗多种疾病的方法。
细胞增殖和死亡是维持生命体发生发展必不可少的环节。正常情况下,机体会通过细胞程序性死亡这一主动机制清除“多余”细胞或即将特化的细胞,从而维持增殖细胞和死亡细胞在数量上的平衡。癌症或其他疾病的发生与细胞稳态失衡有关,为此科学家们已经开始探索利用细胞程序性死亡机制治疗多种疾病的方法。
当地时间5月5日,由美国麻省理工学院霍华德?休斯医学院的研究人员领衔发表在Nature期刊的一项题为Replication stress promotes cell elimination by extrusion的研究报告提出,除细胞程序性死亡之外,机体内存在另一种细胞主动消亡的机制,这也就意味着,人们在面对癌症等疾病时或许还有另一条抑制疾病发生和发展的“通路”。
报告指出,这种新的细胞消亡机制是一种由复制应激反应介导的“细胞挤压”(Cell extrusion)过程。在这个过程中,机体可如挤黑头一般将多余或特化的细胞“挤压”出生存环境,从而维持或恢复细胞内稳态。
该报告的通讯作者、麻省理工学院生物学教授H. Robert Horvitz说:“DNA复制应激是癌前或癌细胞的特征之一。我们发现,这种复制应激反应造成的细胞挤压可能是一种肿瘤抑制机制,这为探索癌症及其他疾病提供了新的思路。”
自上世纪70年代起,H. Robert Horvitz便开始借助秀丽隐杆线虫(C. elegans)探索“细胞死亡”的背后机制,并凭借在器官发育和细胞程序性死亡方面的贡献,成为2002年诺贝尔生理学或医学奖获得者之一。研究过程中,他发现在秀丽隐杆线虫发育的过程中,一共会产生1090个细胞,其中131个细胞通过细胞程序性死亡机制消亡,并且Ced-3是诱发细胞凋亡的主要基因之一。
在2012年7月发表于《Nature》的另一篇文章中,Horvitz进一步提出,如果通过敲除Ced-3基因造成细胞程序性死亡机制失效,131个ABplpappap细胞(注定凋亡的细胞)1中的一部分将通过细胞挤压这一“备用”机制从生存环境中脱落,从而消亡。
为了探索细胞挤压的背后机制,在这项最新试验中,研究人员对秀丽隐杆线虫ORFeome RNAi库中11511个基因进行了筛查,从而找到了14个在细胞周期的DNA合成期(S期)起作用,并且能够产生“Tex”( two excretory cells)表型的细胞周期基因,其中13种基因仅在细胞程序性死亡机制失效(ced-3缺失)的环境中出现。“Tex”表型基因是促进细胞脱落的pig-1基因1的等位基因,这也就意味着这13个基因可能在细胞挤压机制中起作用。
究竟谁是促进细胞挤压机制的“主力选手”?研究人员逐个敲低了13个基因的表达,并用延时共聚焦显微镜追踪了不同条件下ABplpappap细胞被挤出生存环境的过程,发现cye-1和cdk-2这两个基因是细胞挤压机制的必要基因。
更为重要的是,这些细胞在被挤出前均已进入了细胞周期,开始进行DNA复制,但是随后的发展却受到阻滞,并表现出复制应激的多种特征。这说明,复制应激可能直接促成了细胞挤压机制。
为了验证这一猜想,研究人员对ced-3缺失模型中编码关键复制应激反应蛋白的基因进行了RNA干扰(RNAi),发现这些经过处理的基因均产生了Tex表型,说明复制应激反应途径同样是促成细胞挤压机制所必需的因素。
由复制应激反应介导的细胞挤压是否具有进化上的保守性呢?研究人员在哺乳动物细胞中进行了验证,通过使用2mmol / L具有抑制作用的羟基脲(HU)诱导犬肾上皮(MDCK-II)细胞DNA复制应激,并用延时显微镜观测细胞挤出的速率。
结果显示,HU处理使MDCK-II单层细胞的细胞挤出率比对照组快了3倍以上,并且这些被挤出的细胞大多停滞在S期。不仅如此,在哺乳动物细胞中,广为人知的抑癌基因p53同样参与了细胞挤出的过程,并且激活该基因足以在没有复制应激发生的情况下诱导细胞挤出机制。
该报告的主要作者、麻省理工学院博士后Vivek Dwivedi说:“p53在细胞挤出机制中的作用表明,该基因除了具有抑癌作用之外,或许也可通过促使癌细胞或癌前细胞被挤出,从而达到预防或治疗癌症的作用。”
总之,这项研究表明,与细胞程序性死亡机制相同,细胞挤出机制可能是细胞消亡的原始形式之一,并且该过程由复制应激反应诱导,这为人们探索更多疾病疗法开辟了新的思路。
最新动态
- Cell:突破血脑屏障!张明君/王伊龙团队利用纳米颗粒“劫持”颅骨免疫细胞,让药物直达大脑,已开展人体临床试验 2026-01-22 14:56:22
- Adv Sci:上海交通大学王悍等团队发现增强前列腺癌放疗敏感性的潜在新策略 2026-01-22 14:55:23
- Nature:破解ALS自身免疫之谜——找到攻击神经元的“罪魁祸首”C9orf72蛋白,提供免疫治疗新路 2026-01-22 14:54:37
- Nat+Nat Med:破译脊髓损伤后血压紊乱的“神经密码”:揭示对抗性神经元结构,实现仿生电刺激精准双向调控 2026-01-22 14:53:44
- Nature:肠道菌群驱动T细胞可塑性,增强癌症免疫治疗效果 2026-01-22 14:52:51
- 早发糖尿病诊疗发现新依据 2026-01-22 14:51:42
- 肿瘤免疫抑制机制研究有新发现 2026-01-22 14:50:48
- 关节软骨损伤修复有新思路 2025-11-06 14:09:12
- 微型神经植入物可监测脑活动 2025-11-06 14:08:23
- Nature重磅:老药新用,逆转瘫痪!计算机虚拟筛选,发现脊髓损伤的再生疗法 2025-11-06 14:07:38







